¿Cuales son las propiedades periódicas de los elementos químicos?
- El carácter metálico y no metálico.
| Equipo | Propiedades periódicas de los elementos. |
| 1 | La configuración electrónica La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. |
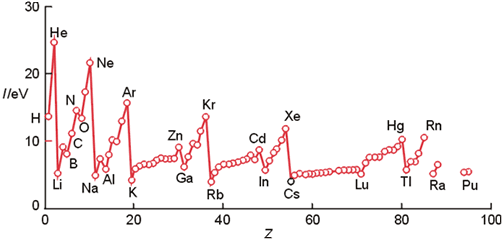
| 2 | La energía de ionización.- La energía de ionización, potencial de ionización o EI es la energía necesaria para arrancar un electrón de un átomo perteneciente a una sustancia que se encuentra en estado gaseoso. La reacción puede expresarse de la siguiente forma: Siendo A(g) los átomos neutros de una sustancia elemental en estado gaseoso; EI, la energía de ionización y un electrón. |
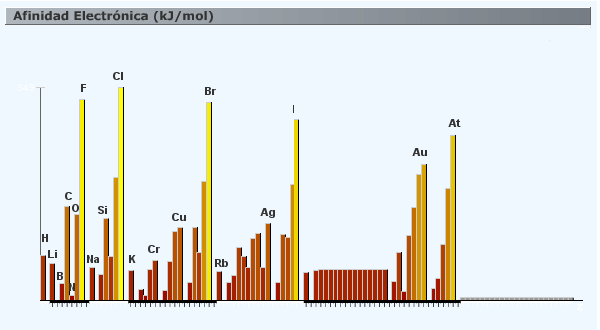
| 3 | La afinidad electrónica. se define como la energía involucrada cuando un átomo gaseoso neutro en su estado fundamental (de mínima energía) captura un electrón y forma un ion mononegativo: . Dado que se trata de energía liberada, tiene signo negativo. En los casos en los que la energía sea absorbida, tendrá signo positivo. La electroafinidad aumenta cuando el tamaño del átomo disminuye, el efecto pantalla aumenta y cuando el nº atómico disminuye. Visto de otra manera: aumenta de izquierda a derecha, y de abajo hacia arriba, al igual que lo hace la electronegatividad |
| 4 | La electronegatividad.
los electrones, o densidad electrónica, cuando forma un enlace covalente en una molécula. |
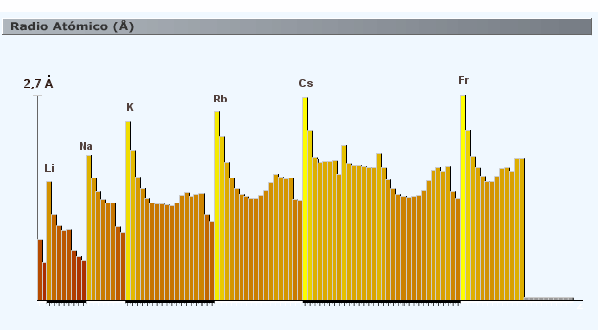
| 5 | El volumen atómico.- es el volumen que ocupa un mol de átomo del elemento considerado. Se obtiene según la siguiente fórmula: Vol atom = masa atómica / densidad. Se mide en unidades de volumen por mol, por ejemplo, cc/mol. |
| 6 | El número de oxidación. Las reglas para los números de oxidación pueden deducirse si se tiene en cuenta lo dicho con respecto a que los elementos, al unirse, pierden, ganan o comparten electrones para llegar a una estructura más estable. Los números de oxidación son consecuencia de esto. |
Conclusión:
-Al analizar la ordenación de los átomos en la tabla periódica, observamos que, en los grupos, las propiedades de estos son semejantes y en los períodos tienen una variación que podemos explicar. Pero es importante destacar que las propiedades de los átomos son debidas a la naturaleza de los mismos, y no a su localización en la tabla.


Sharon.Saludos.Queda registrado.
ResponderEliminarProf. Agustín